Einleitung
Die sekundäre Mitralklappeninsuffizienz (SMI) stellt eine relevante prognostische Determinante bei Patientinnen und Patienten mit Herzinsuffizienz dar. Neben der optimierten Pharmakotherapie kommen zunehmend katheterbasierte Verfahren zum Einsatz. Das CARILLON®-System ermöglicht eine indirekte Mitralannuloplastie über den Koronarsinus.

Dawood Wahidi
Hintergrund
Die sekundäre Mitralklappeninsuffizienz (SMI) entsteht infolge einer linksatrialen und/oder linksven-trikulären Dilatation mit konsekutiver Annulusdilatation und einem Koaptationsdefizit der Mitralsegel [1]. Im Unterschied zur primären Mitralklappeninsuffizienz liegt keine strukturelle Degeneration des Klappenapparats vor. SMI tritt häufig bei systolischer oder diastolischer Herzinsuffizienz auf und ist mit erhöhter Morbidität und Mortalität assoziiert [2].
Die aktuelle ESC/EACTS-Leitlinie (European Association for Cardio-Thoracic Surgery/European Society of Cardiology) zur Behandlung von Herzklappenerkrankungen empfiehlt bei persistierender symptomatischer sekundärer Mitralklappeninsuffizienz (SMI) trotz optimaler medikamentöser Herzinsuffizienztherapie eine Beurteilung durch ein interdisziplinäres Herzteam [3]. Ziel ist die Identifikation potenzieller Patientinnen und Patienten für katheterbasierte Verfahren wie das transka-theterale Edge-to-Edge-Repair (TEER) oder eine Annuloplastie. Für TEER-Verfahren besteht bei geeigneter Anatomie eine Klasse-IIa-Empfehlung bei hohem oder sehr hohem Operationsrisiko [3].
Für die persistierend mittel- bis hochgradige sekundäre Mitralklappeninsuffizienz trotz optimierter Herzinsuffizienztherapie kommen zusätzlich zu TEER auch andere kathetergestützte Rekonstruktionsverfahren in Frage, wenn anatomische Voraussetzungen dies zulassen. Hierbei handelt es sich um ein hochselektioniertes Patientenkollektiv, für das derzeit nur wenige Daten vorliegen [4]. Dazu zählt das CARILLON® Mitral Contour System als innovatives Verfahren der indirekten Mitralannuloplastie über den Koronarsinus, ohne direkte Manipulation der Mitralsegel. Aufgrund der bisher limitierten klinischen Evidenz und anatomischen Einschränkungen wird das System derzeit nur bei sorgfältig ausgewählten Patientinnen und Patienten mit geeigneter Anatomie in Erwägung gezogen und gilt nicht als etabliertes Verfahren.
Das CARILLON®-System besitzt eine CE-Kennzeichnung, damit ist die Anwendung in Europa zugelassen. Die Herstellerunterlagen und Produktinformationen geben an, dass das System zur Behandlung symptomatischer Patienten mit moderater bis schwe-
rer sekundärer Mitralklappeninsuffizienz indiziert ist, wenn trotz optimaler medikamentöser Therapie weiterhin Symptome bestehen und eine direkte chirurgische oder interventionelle Rekonstruktion nicht infrage kommt. Diese Indikationsstellung entspricht den Herstellerangaben und der klinischen Studienlage [5].
Für eine sichere und effektive Implantation ist eine sorgfältige anatomische und klinische Selektion erforderlich. Wichtige relative und absolute Ausschlusskriterien sind: ungünstige Anatomie von
Sinus coronarius/Great Cardiac Vein in Relation zum Mitralannulus, vorhandene Implantate im Sinus coronarius, Voroperationen mit Mitralklappenersatz oder bestehendem Annuloplastiering, ausgeprägte Mitralklappen- bzw. Annuluskalzifikation, Risiko bzw. Nachweis kritischer Koronararterienkompression (insbesondere Versorgung durch den linken Ramus circumflexus), aktive Infektionen, nicht korrigierbare Koagulopathien sowie schwere primäre Klappenerkrankungen mit Operationsindikation. Hersteller-Informationsblätter und klinische Studien listen diese Punkte konsistent auf [5, 6, 7, 8, 9].
Die Implantation erfolgt perkutan (häufig über die Vena jugularis interna oder die Vena femoralis) im Herzkatheterlabor oder Hybrid-OP. Während der Prozedur sind Venographie des Koronarsinus, simultane Koronarangiographie (obligat zur Ausschlussdiagnostik einer Koronararterienkompression), transösophageale Echokardiographie (TEE, idealerweise 2D/3D) und Fluoroskopie erforderlich. Intraprozedural wird eine standardisierte Antikoagulation (Heparin, analog zu perkutaner Koronarintervention) angewendet. Für erste Eingriffe wird strukturiertes Proctoring durch erfahrene CARILLON®-Implanteure empfohlen [5].
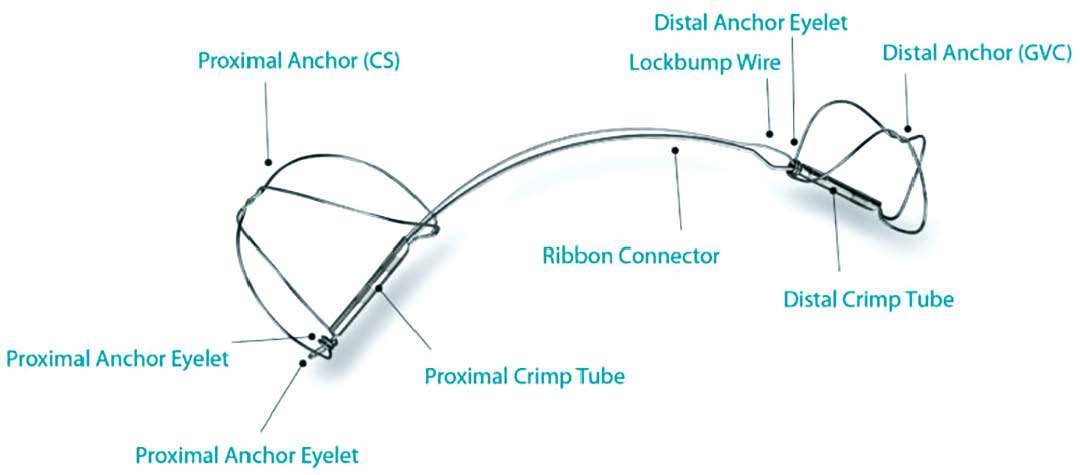
Abbildung 1: CARILLON®-System zur indirekten Mitralklappenannuloplastie
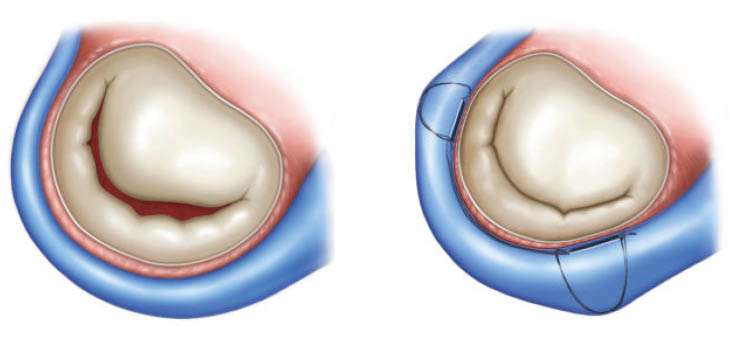
Abbildung 2: Schematische Darstellung der Mitralklappeninsuffizienz mit Koronarsinus vor (li.)und nach (re.) CARILLON®-System-Implantation
Wesentliche prozedurale Risiken sind akute Koronararterienkompression (mit Myokardischämie bis hin zur Notwendigkeit einer einer Perkutanen Koronarintervention [PCI]), Koronar-Sinus-Verletzung mit Perikarderguss/Tamponade, Zugangsassoziierte Gefäßkomplikationen/Blutungen, Arrhythmien sowie device-assoziierte Ereignisse (Dislokation, in frühen Generationen gelegentlich Ankerfrakturen). Kontrastmittelassoziierte Nierenschädigung ist ein grundsätzliches Risiko bei angiographischen Verfahren. Klinische Studien und Registerdaten berichten insgesamt über ein akzeptables Sicherheitsprofil, betonen jedoch die Notwendigkeit präziser anatomischer Bewertung vor Implantation.
Randomisierte, kontrollierte Daten aus Studien zeigten eine signifikante Reduktion des Regurgitationsvolumens und Hinweise auf linksventrikuläres Reverse-Remodelling sowie frühe Verbesserungen von Symptomen und funktioneller Kapazität im Vergleich zur Kontrollgruppe. Verbesserungen können bereits nach Wochen bis wenigen Monaten objektiviert werden und persistieren typischerweise über 6 bis 12 Monate in den publizierten Follow-up-Zeiträumen, Langzeitdaten werden weiterhin erhoben [6, 7, 9].
Es existiert kein einheitlicher, evidenzbasierter Standard zur postprozeduralen antithrombotischen Therapie nach CARILLON®-Implantation. Herstellerangaben und klinische Praxisberichte empfehlen eine Individualisierung: bei bestehenden Indikationen für orale Antikoagulation (z. B. Vorhofflimmern) wird diese fortgeführt, bei Bedarf an dualer Plättchenhemmung (DAPT) variiert die Praxis – kurze DAPT-Zeiträume (z. B. 6 bis 12 Wochen) werden in Fallserien und Praxisanleitungen genannt, sind jedoch nicht durch große randomisierte Studien speziell für CARILLON® standardisiert. Die allgemeine Evidenz zur DAPT-Dauer nach koronaren Interventionen lässt kürzere Regime unter bestimmten Bedingungen zu, ist aber nicht direkt auf sinus-basierte Annuloplastie übertragbar; eine individuelle Abwägung von Thrombose- vs. Blutungsrisiko ist zwingend [10].
Reinterventionen (interventionell oder chirurgisch) können notwendig werden bei unzureichender Reduktion der Mitralregurgitation, Implantatkomplikationen (z. B. Dislokation) oder progredienter kardialer Grunderkrankung. In Fällen persistierender oder progredienter SMI nach 3 bis 6 Monaten kann eine zusätzliche Therapie mit einem transkatheterbasierten „edge-to-edge“ Verfahren (z. B. MitraClip) in Erwägung gezogen werden. Diese Option sollte im interdisziplinären Heart-Team präprozedural bedacht werden [11].
Eine standardisierte, veröffentlichte Durchschnittsstrahlendosis für die CARILLON®-Implantation existiert nicht, Strahlenexposition und Kontrastvolumina variieren mit Zentrumserfahrung, eingesetzten Bildgebungsprotokollen (Tooling, 3D-Fusion, TEE-Support) und Patientenanatomie [11]. Für die Kodierung des Eingriffs in Deutschland steht ein spezifischer OPS-Code zur Verfügung (5-35a.45: minimalinvasive Mitralklappenannuloplastik über den Koronarsinus), es besteht zudem eine InEK-Regelung mit zugehöriger DRG-Zuordnung [12, 13].
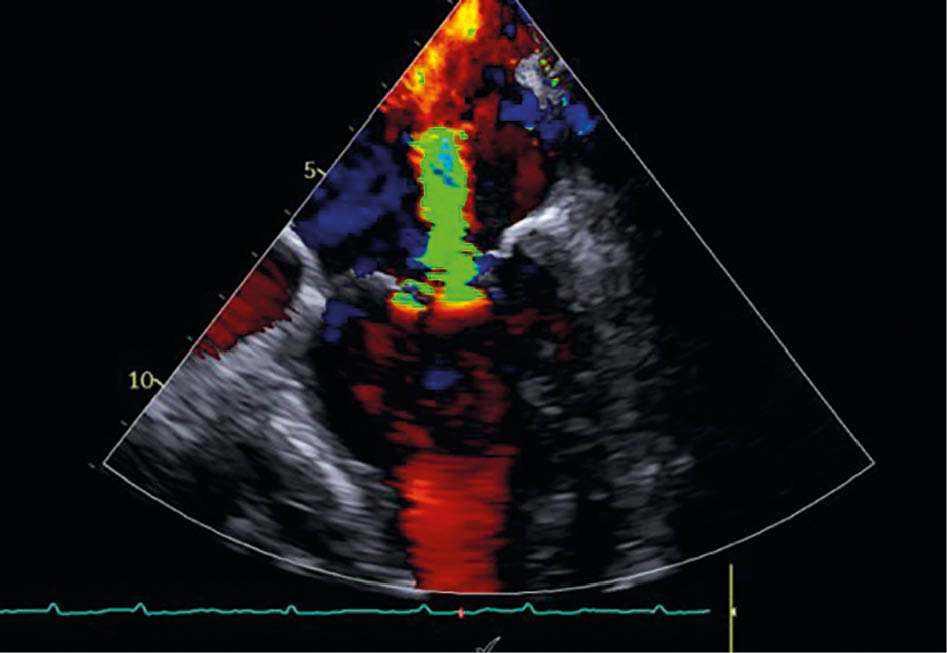
Abbildung 3a: Mitralklappeninsuffizienz in TEE vor der Behandlung
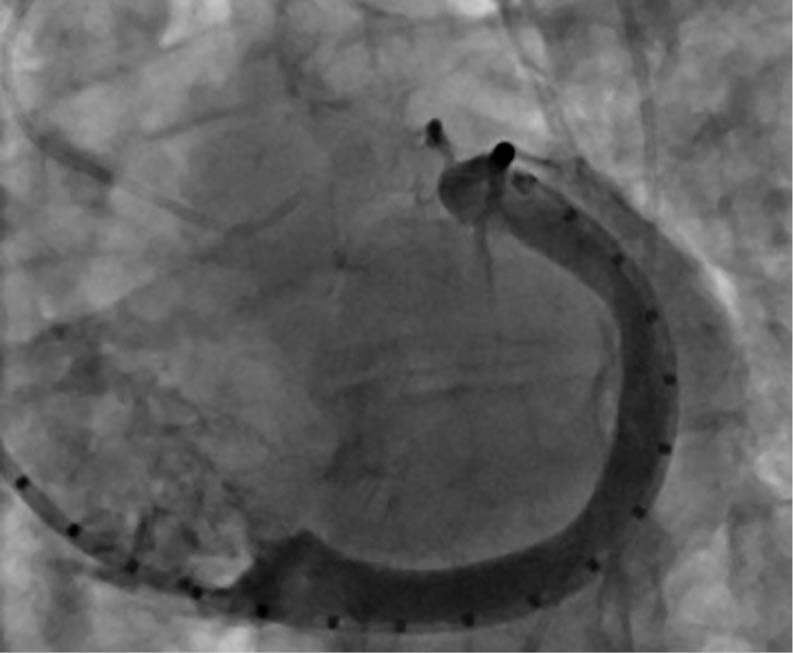
Abbildung 3b: intraprozedurales „Sizing“
unter der Fluoroskopie
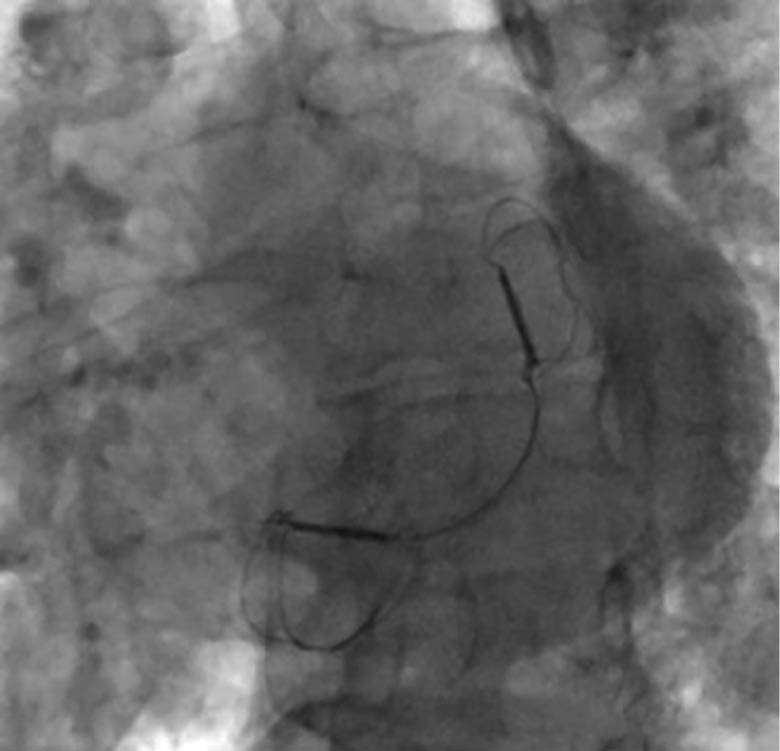
Abbildung 3c: Endergebnis des CARILLON®-Systems
unter der Fluoroskopie
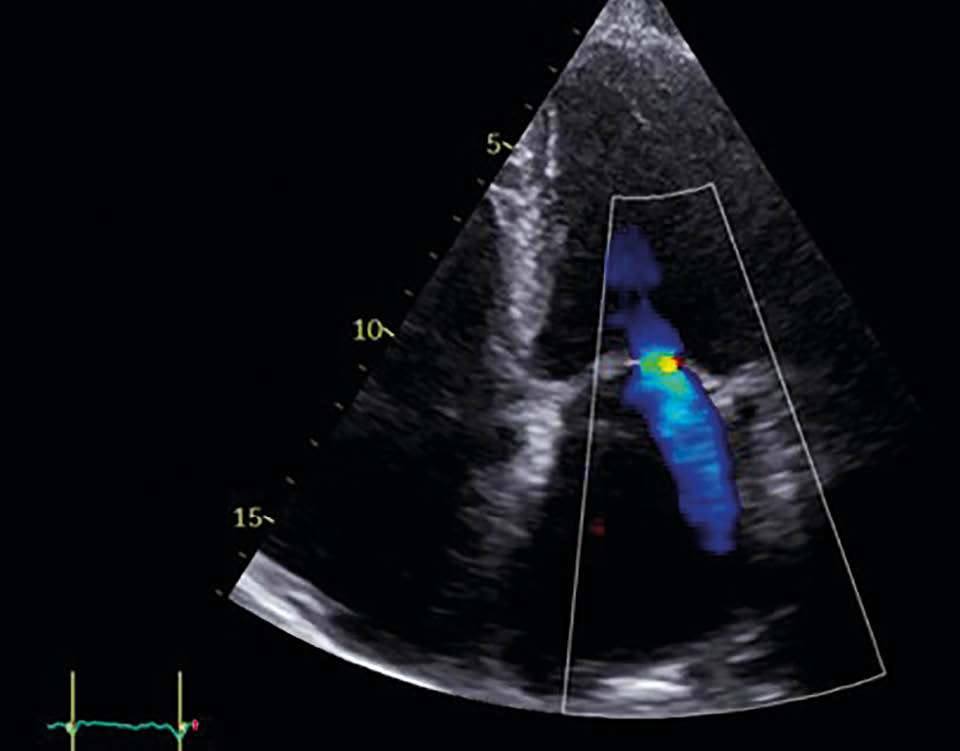
Abbildung 3d: Mitralklappeninsuffizienz in TTE
nach der Behandlung
Ziel des Manuskripts
Darstellung eines klinischen Falles mit einer erfolgreichen CARILLON®-Implantation bei SMI vor dem Hintergrund aktueller evidenzbasierter Leitlinien der ESC.
Fallpräsentation
Klinische Vorstellung
Eine 84-jährige Patientin mit bekannter Herzinsuffizienz bei erhaltener Pumpfunktion (HFpEF, LVEF 50 %) und symptomatischer Belastungsdyspnoe (NYHA III: Treppensteigen nur mit Einschränkungen möglich) wurde in der Klinik vorstellig. Die transthorakale Echokardiographie ergab eine schwere sekundäre Mitralklappeninsuffizienz (effektive Regurgitationsfläche EROA: 0,5 cm2) bei ausgeprägter linksatrialer Dilatation (Volumenindex 64 ml/m2). Als weitere Diagnosen sind eine arterielle Hypertonie und chronisch permanentes Vorhofflimmern bekannt. Die konservative Therapie bestand aus ACE-Hemmer, Betablocker, Schleifendiuretikum und SGLT2-Inhibitor. Trotz maximaler medikamentöser Therapie persistierte eine relevante Symptomlast.
Indikationsstellung
Im interdisziplinären Herzteam wurde nach Ausschluss einer proportionalen MI mittels EROA in Relation zum linksventrikulären enddiastolischen Volumen (LVEDV) und fehlender Eignung für TEER aufgrund suboptimaler Koaptationshöhe die Entscheidung zur CARILLON®-Implantation getroffen.
Prozedur
Die Implantation eines 60-mm-Carillon®-Systems erfolgte unter fluoroskopischer und TEE-gestützter Kontrolle nach vorheriger intraprozeduraler Größenauswahl und Anpassung in Analgo-
sedierung. Die Implantation verlief komplikationslos. Eine angiographische Kontrolle schloss eine relevante Kompression des RCX und der RCA aus. Die Interventionsdauer betrug 45 Minuten, die Durchleuchtungszeit 11 Minuten.
Ergebnisse
Postinterventionell zeigte sich echokardiografisch eine Reduktion der MI auf Grad 1 mit deutlicher Abnahme des EROA auf 0,1 cm2. Die Patientin berichtete bereits am ersten postinterventionellen Tag über eine deutliche Besserung der Dyspnoe. Die Entlassung erfolgte am zweiten postprozeduralen Tag unter stabilen hämodynamischen Verhältnissen. Die strukturelle Nachsorge ist über den niedergelassenen Kardiologen in enger Zusammenarbeit mit der kardiologischen Klinik organisiert (TTE-Kontrollen nach 1, 3 und 6 Monaten, Laborparameter, 6-Minuten-Gehtest [6MWT]).
Diskussion
Das CARILLON®-System nutzt die Anatomie des Koronarsinus zur indirekten Reduktion des Mitralannulus. Klinische Studien wie TITAN [6], TITAN II [8] und REDUCE-FMR [9] zeigten signifikante Verbesserungen der Regurgitationsparameter und tendenzielle Verbesserungen der LV-Geometrie. Die CINCH-FMR-Registerdaten bestätigen darüber hinaus die Langzeit-Sicherheit des Systems über fünf Jahre [14].
Im Gegensatz zum TEER-Verfahren bleibt die Mitralklappe funktionell intakt – ein Vorteil bei Patientinnen und Patienten mit annulusdominierter Insuffizienz, insbesondere im HFpEF-Setting. Diese Patientengruppe wird in den ESC-Leitlinien als therapeutisch unterversorgt bezeichnet. Während TEER bei HFrEF und disproportionierter MI stärker empfohlen wird (Klasse IIa), bietet die CARILLON®-Therapie eine realistische Alternative bei ungeeigneter Mitralklappenanatomie für TEER-Verfahren [1, 9].
Wesentlich für den Therapieerfolg ist eine präzise Patientenselektion, basierend auf einem strukturierten echokardiographischen und funktionellen Assessment sowie eine enge Einbindung in ein Herzinsuffizienz-Netzwerk.
Schlussfolgerung
Die CARILLON®-Implantation ist eine sichere und effektive Option zur Behandlung der sekundären Mitralinsuffizienz, insbesondere bei Patientinnen und Patienten mit HFpEF und annulusdominierter Pathophysiologie. Die Integration dieses Verfahrens in das therapeutische Gesamtkonzept muss unter Einhaltung der ESC-Leitlinien erfolgen und bedarf einer interdisziplinären Beurteilung im Herzteam. Langfristige Outcome-Daten und direkte Vergleichsstudien zu anderen Techniken sind für eine definitive Einordnung innerhalb der Leitlinien erforderlich.
Abbildungen 1 und 2: Mit freundlicher Genehmigung von Cardiac Dimensions®/Kirkland/USA
Abbildungen 3 a-d: Carl-von-Basedow-Klinikum Saalekreis, Medizinische Klinik I, Kardiologie, Angiologie und Diabetologie
Korrespondenzanschrift
Dawood Wahidi
Facharzt für Innere Medizin und Kardiologie
Anerkannter interventioneller Kardiologe der DGK
Chefarzt der Medizinischen Klinik I
Kardiologie, Angiologie und Diabetologie
Carl-von-Basedow-Klinikum Saalekreis gGmbH
Akademisches Lehrkrankenhaus der
Martin-Luther-Universität Halle-Wittenberg
Weiße Mauer 52, 06217 Merseburg
-
ACEAngiotensin-converting-enzyme
-
CARILLON®CARILLON® Mitral Contour System
-
CEConformité Européenne
-
DAPTDual antiplatelet therapy
-
DRGDiagnosis Related Groups
-
EACTSEuropean Association for Cardio-Thoracic Surgery
-
EROAEffective regurgitant orifice area
-
ESCEuropean Society of Cardiology
-
HFpEFHeart failure with preserved ejection fraction
-
HFrEFHeart failure with reduced ejection fraction
-
InEKInstitut für das Entgeltsystem im Krankenhaus
-
LVLeft ventricle
-
LVEDVLeft ventricular end-diastolic volume
-
LVEFLeft ventricular ejection fraction
-
MIMitral insufficiency
-
NYHANew York Heart Association
-
OPSOperationen- und Prozedurenschlüssel
-
PCIPercutaneous coronary intervention
-
RCARight coronary artery
-
RCXRamus circumflexus
-
REDUCE-FMRRandomized Evaluation of a Device
Used to Treat Functional Mitral Regurgitation -
SGLT2Sodium-glucose cotransporter 2
-
SMISekundäre Mitralklappeninsuffizienz
-
TEETransoesophageal echocardiography
-
TEERTranscatheter edge-to-edge repair
-
TITANTranscatheter Implantation of Carillon Mitral
Annuloplasty Device -
TTETransthoracic echocardiography
-
6MWTSix-minute walk test
Literatur
- Vahanian A, Beyersdorf F, Praz F, Milojevic M, Baldus S, Bauersachs J, et al. 2021 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2022;43(7):561–632. doi:10.1093/eurheartj/ehab395
- Bursi F, Enriquez-Sarano M, Nkomo VT, et al. Heart failure and death after myocardial infarction in the community: the emerging role of mitral regurgitation. 2005;111(3):295–301. doi:10.1161/01.CIR.0000151097.30779.04.
- ESC/EACTS. 2025 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2025;46(44):4635-4736. doi:10.1093/eurheartj/ehaf194
- Baldus S, Bekeredjian R, Ouarrak T, et al. Positionspapier zur interventionellen Therapie der sekundären Mitralklappeninsuffizienz in Deutschland. Kardiologe. 2024;18:203–220. doi:10.1007/s12181-024-00635-0.
- Cardiac Dimensions Inc. Carillon Mitral Contour System: Instructions for Use (IFU). Kirkland, WA: Cardiac Dimensions; 2021–2023.
- Siminiak T, Hering D, Kasprzak JD, et al. Percutaneous mitral annuloplasty with the Carillon device: 1-year outcomes in the TITAN trial. Eur J Heart Fail. 2014;16(4):438–445. doi:10.1002/ejhf.57.
- Lipiecki J, et al. Coronary sinus-based percutaneous annuloplasty and early clinical results. Int J Cardiol. 2016.
- Siminiak T, Hering D, Lengyel M, et al. Indirect mitral annuloplasty using the Carillon device: TITAN II results. 2017;13(11):e1283–e1288. doi:10.4244/EIJ-D-17-00499.
- Witte KK, Lipiecki J, Siminiak T, Meredith IT, Malkin CJ, Goldberg SL, et al. The REDUCE-FMR Trial: a randomized sham-controlled study of percutaneous mitral annuloplasty in functional mitral regurgitation. JACC Heart Fail. 2019;7(11):951–960. doi:10.1016/j.jchf.2019.06.011
- Gargiulo G, et al. Duration of dual antiplatelet therapy: State-of-the-art. Ergänzt durch Übersichtsarbeiten in JAMA Cardiol. 2023–2024
- Real-world registry report on CARILLON system: outcomes, complications and learning curve. TCTMD Report. Feb 2025.
- Bundesministerium für Gesundheit. OPS-Katalog: 5-35a.45 Mitralklappenanuloplastik über den Koronarsinus. gesund.bund.de.
- Cardiac Dimensions. Pressemitteilung: DRG/Erstattungs-Zuweisung für das CARILLON-System in Deutschland. 2018.
- Yildiz M, Witte K, et al. The CINCH FMR post market registry: real world long term outcomes with percutaneous mitral valve repair with the Carillon Mitral Contour System. Cardiovascular Revascularization Medicine. 2024;60:35–40.