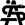Trotz maßgeblicher Verbesserungen in der Versorgung von Patientinnen und Patienten mit Hämoglobinopathien bleibt die allogene HSZT aktuell die einzige verfügbare kurative Therapieoption. Hämatopoetische Stammzellen (HSCs) befinden sich in den Nischen des Knochenmarks (BM) und bilden lebenslang die peripheren Blutzellen. Somit kann der Austausch durch gesunde Spenderinnen-/Spender-HSCs bei einer angeborenen hämatologischen Erkrankung wie Beta-Thalassämie und Sichelzellkrankheit zu einer Heilung führen.
Die Hauptindikation für eine HSZT bei Thalassämie-Patientinnen und -Patienten ist die Transfusionsabhängigkeit. Bei allen Kindern mit transfusionsabhängiger Thalassämie, die eine/n verfügbare/n gesunde/n HLA-identische/n verwandte/n Spenderin/Spender (in der Regel ein Geschwister) haben, sollte die HSZT so früh wie möglich angeboten werden (10). Um das Risiko von Komplikationen im Verlauf der HSZT einschätzen zu können, hat die Pesaro-Gruppe einen prognostischen Score für Patientinnen und Patienten unter 17 Jahren entwickelt und sie in 3 Risikogruppen eingeteilt, wobei die adäquate Eisenchelation, die Hepatomegalie und die portale Fibrose berücksichtigt wurden (11).
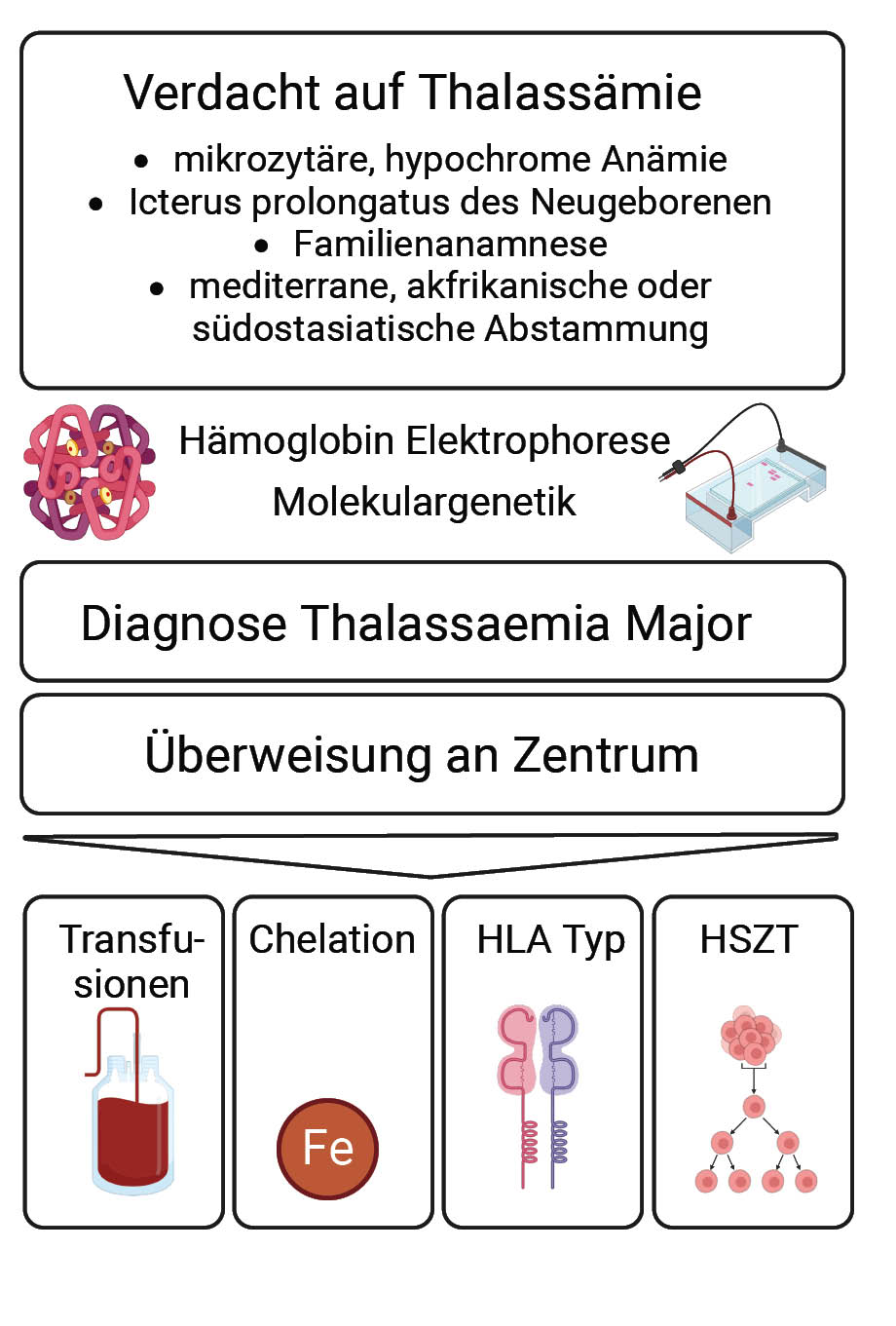
Da die klinischen Phänotypen der Sichelzellkrankheit variieren, sind die Indikationen für eine HSZT bei Patientinnen und Patienten mit Sichelzellkrankheit, im Gegensatz zu jenen mit Thalassämie, nicht universell definiert. Eine der allgemein akzeptierten Indikationen für HSZT bei Sichelzellkrankheit ist die Erkrankung des zentralen Nervensystems – verbunden mit dem Risiko wiederkehrender oder fortschreitender zerebraler Infarkte – trotz angemessener Transfusionstherapie. Andere schwere Komplikationen wie Osteonekrosen, pulmonale Hypertonie, Sichelzellnephropathie, rezidivierende venöse okklusive Krisen, akutes Thoraxsyndrom und Milzsequestrationskrise können ebenfalls als Indikationen für HSZT in Betracht gezogen werden, da sie mit einer erheblichen Morbidität und Beeinträchtigung der Lebensqualität einhergehen.
Die präventiven Strategien zusammen mit der Behandlung mit Hydroxycarbamid haben in den letzten zwei Jahrzehnten zu erheblichen Verbesserungen der Überlebenschancen von Kindern beigetragen. Dennoch ist die Mortalität bei erwachsenen Patientinnen und Patienten erheblich. Die HSZT von einem HLA-identischen Geschwisterkind ist Therapiestandard bei Patientinnen und Patienten mit Sichelzellkrankheit und mit einem ereignisfreien Überleben (EFS) nach 5 Jahren von 91,4 % und einem Gesamtüberleben (OS) nach 5 Jahren von 92,9 % vergesellschaftet. Die Erfahrungen mit HSZT von passenden Fremd- und haploidentischen Spenderinnen und Spendern bei Patientinnen und Patienten mit Sichelzellkrankheit sind demgegenüber gering (10; 12; 13).