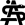Einleitung
Die Mediasklerose wurde 1903 als eigenständiges klinisches Krankheitsbild von dem Hamburger Professor der Pathologie Johann Georg Mönckeberg jun. (1877 – 1925) beschrieben.1
Anhand der von ihm durchgeführten Autopsien von 55 Patienten von jünger als 40 bis älter als 80 Jahre folgerte Mönckeberg:
- Die Mediaverkalkung ist an den Arterien der Extremitäten sehr viel häufiger, als die Arteriosklerose.
- Sind die Extremitätenarterien als „starre, geschlängelte, fragile Rohre“ zu fühlen, so handelt es sich in der weitaus überwiegenden Mehrzahl der Fälle um eine Mediaverkalkung, nicht um eine Arteriosklerose.
- Weder aus dem Grade, noch aus der Ausdehnung der peripherischen Mediaverkalkung darf auf eine Arteriosklerose zentraler Gefäße ohne weiteres geschlossen werden; beide Erkrankungen finden sich häufig kombiniert, doch kommen Fälle hochgradigster Mediaverkalkung peripherischer Arterien vor ohne jegliche Arteriosklerose innerer Gefäße.
Nahezu zeitgleich, 1904, wurde in dem Sammelband „Abhandlungen der Gesellschaft für Innere Medizin“ die Histologie der Mediasklerose von dem zunächst in Halle, später in Leipzig tätigen Pathologen Professor Felix Marchand (1846 – 1928) beschrieben und von der Arteriosklerose eindeutig abgegrenzt.2 Es ist kurios, dass in der Folgezeit nicht nur in der Fachliteratur, sondern auch in der klinischen Medizin, die Mediasklerose entweder fälschlicherweise der Arteriosklerose zugeordnet, oder als klinisch belanglos abgetan wurde.3
Nach dem heutigen Wissensstand besteht kein Zweifel daran, dass die Mediasklerose Mönckeberg (im Englischen Schrifttum Medial Arterial Calcification) den Ausdruck einer Gefäßalterung mit einer hohen interindividuellen Variabilität darstellt. Obwohl dabei die Beinarterien bevorzugt betroffen werden, kann die Mediasklerose prinzipiell in allen Gefäßregionen vorkommen. Dieser Alterungsprozess kann, insbesondere in Verbindung mit Diabetes mellitus und Chronischen Nierenkrankheiten, schwere periphere Durchblutungsstörungen verursachen. Somit stellt die Mediasklerose einen häufigen Befund bei Patienten mit einer chronischen kritischen Beinischämie, und bei Patienten nach Gliedmaßen-Amputationen dar. Trotz Fortschritte ist die molekulare Pathogenese der Mediasklerose bisher nicht restlos aufgeklärt und folglich ist bisher keine kausale Therapie bekannt. Bei Patienten mit schweren peripheren Durchblutungsstörungen werden offene oder die endovaskuläre Revaskularisation durchgeführt. In der vorliegenden Darstellung wird der aktuelle Wissensstand über die Mediasklerose Mönckeberg anhand der aktuellen umfangreichen Gesamtdarstellung4 zusammengefasst und der Leserschaft zugänglich gemacht.
Definition
Die Mediasklerose Mönckeberg ist ein systemischer, degenerativer Prozess der Arterien mit Einbeziehung der nachgeschalteten Strombahn, der bei prädisponierten Patienten auch ohne Vorliegen der Arteriosklerose, und ohne den für die Arteriosklerose typischen Gefäßstenosen, zu schweren peripheren Durchblutungsstörungen führen kann. Die Prädilektionsstelle für Mediasklerose sind die Arterien der unteren Extremitäten.
Epidemiologie
Die genaue Prävalenz der Mediasklerose ist nicht bekannt. In der Fachliteratur schwanken die Angaben in Abhängigkeit von der untersuchten Patientenkohorte und von der Bestimmungsmethode zwischen wenigen Prozentpunkten bis nahezu 100 Prozent. Bei Anwendung des Knöchel-Arm Indexes (Ankle-Brachial Index, ABI) ≥ 1.4 als Grenzwert kann eine Prävalenz von etwa 2 % in der allgemeinen Bevölkerung, mit leichter Bevorzugung des männlichen Geschlechts, angenommen werden.5 Hierbei sind jedoch zwei wesentliche Einschränkungen zu berücksichtigen; erstens, führen auch andere Faktoren zu einer verminderten Kompressibilität der peripheren Arterien; zweitens, mit dem ABI werden lediglich bereits weit fortgeschrittene Spätstadien der Mediasklerose erfasst.
Histologie
In den Frühstadien der Mediasklerose sind kleine Verkalkungsherde, oft in der Nähe der Elastica interna, nachweisbar. Diese fokalen Verkalkungen vergrößern sich und bilden schließlich zusammenhängende Kalkplatten. In weit fortgeschrittenen Stadien wird die Media weitgehend zerstört. Neben den Verkalkungen gehört, insbesondere in den distalen Abschnitten der Arterien, eine obliterierende Intima Proliferation zum histologischen Bild. In Endstadien werden nicht selten Kalkknoten sowie echte, ektope Knochenherde nachgewiesen (Abbildung 1). Im Unterschied zur Arteriosklerose mit Nachweis von Intima Verkalkungen sind in der MM die Verkalkungen in der Media lokalisiert, wobei bei vollständiger Zerstörung der Elastica interna die Grenzen zu Intima fließend sind und eine Unterscheidung zwischen der Mediasklerose und Arteriosklerose erschwert sein kann.
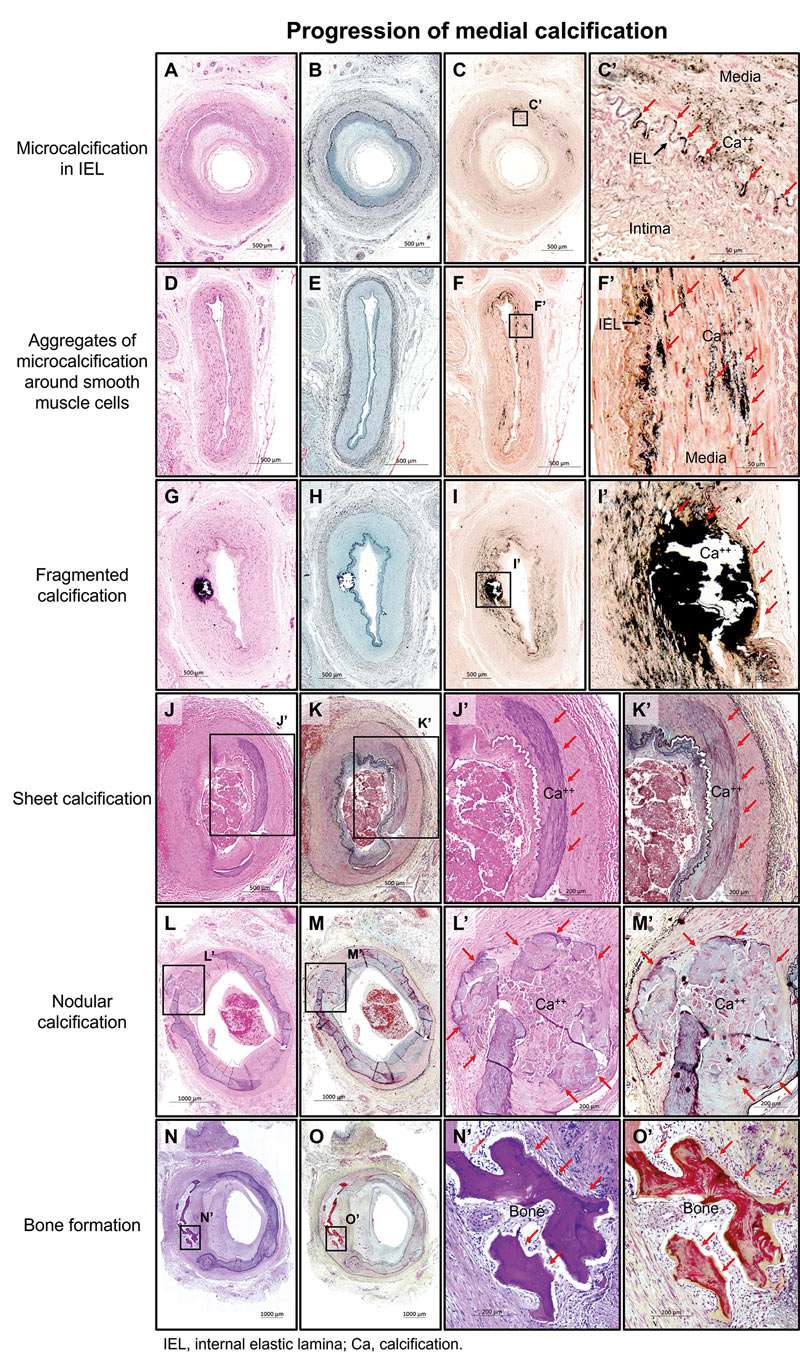
Abbildung 1: Fortschreiten der medialen Kalzifikation. Die Kalzifikation beginnt mit Mikrokalzifikationen (> 0,5 μm) in der inneren elastischen Lamina (Elastica interna), sichtbar in A–C mit Hämatoxylin-Eosin-, Movat-Pentachrom- und von-Kossa-Färbungen (schwarze Bereiche zeigen Kalzifikation). In C ist eine hochauflösende Darstellung des markierten Bereichs zu sehen, wobei rote Pfeile auf Mikrokalzifikationen in der inneren elastischen Lamina (Elastica interna) hinweisen. Mikrokalzifikationen erscheinen auch um die glatten Muskelzellen der Media und bilden kleine Aggregate (D–F und rote Pfeile in F). Größere Aggregate der Kalzifikation werden als fragmentierte Kalzifikationen bezeichnet (> 1 mm, aber < 3 mm; G – I und rote Pfeile in I). Schließlich bilden sich Kalzifikationsplatten, die mindestens einen Mediensektor bedecken (J und K, rote Pfeile in J und K). Noduläre Kalzifikationen treten auf, wenn verkalkte Platten zerbrechen und Fragmente durch Fibrin voneinander getrennt sind (L, M, rote Pfeile in L und M). Knochenbildung (N, O, rote Pfeile in N und O) tritt in stark verkalkten Bereichen auf und ist bei 15 – 20 % der Patienten mit peripherer arterieller Verschlusskrankheit nachweisbar. Ca++, Kalzifikation; IEL, innere elastische Lamina; SMC, glatte Muskelzelle. (reproduziert mit freundlicher Genehmigung des European Heart Journal).
Pathogenese
Degenerative Veränderungen der elastischen Fasern, insbesondere im Bereich der Elastica interna, kommen als primäre Verkalkungsherde in Betracht. Einige monogenetisch vererbte Erkrankungen weisen in ihrem Phänotyp eine ausgeprägte Mediasklerose auf. Bei diesen Krankheiten ist der Stoffwechsel des extrazellulären Adenosins gestört. Polygenetische Komponenten der molekularen Pathogenese der Mediasklerose werden vermutet, entsprechende Untersuchungen liegen jedoch bisher nicht vor. Die bisherigen Untersuchungen der molekularen Pathogenese der Mediasklerose weisen auf eine heterogene Kausalität hin. Dabei kommt der genetischen Umprogrammierung der vaskulären, kontraktilen glatten Muskelzellen in sekretorische glatte Muskelzellen eine zentrale Bedeutung zu. Diese Umprogrammierung ist Folge einer Vielzahl von unterschiedlichen Signalwegen (Abbildung 2). Bei Gefäßalterung sind vor allem die direkten Schädigungen der DNS, Verkürzungen der Telomere, Störungen des Abbaus der Sauerstoff-Radikale (oxidativer Stress), Störungen des Energiestoffwechsels in den Mitochondrien u. a. bedeutsam. Bei Diabetikern sind vor allem die Anhäufung der AGEs (advanced glycation end-products) und die Aktivierung der AGE/AGE-Rezeptoren Achse bedeutsam. Bei Patienten mit chronischen Nierenkrankheiten sind besonders Störungen der extra- und intra-zellulären Phosphat-Homöostase, entscheidend. Wichtig erscheint, dass diese Umprogrammierung oft über gemeinsame molekulare Signalwege abläuft. Dabei ist insbesondere die Aktivierung des Runx2 (runt-related transcription factor 2), des osteogenen Master Transkription Faktors, bedeutsam.
Die sekretorischen glatten Muskelzellen produzieren eine Reihe von prokalzinogenen extrazellulären Vesikeln, welche, neben den gleichzeitig ablaufenden molekularen Veränderungen der extrazellulären Matrix, die Kalzium-Phosphat Homöostase stört. Dazu trägt das Ungleichgewicht zwischen den Promotoren (alkalische Phosphatase, hohe Phosphat Konzentration, Hochregulation der Wnt/β-catenin Signalweg u. a.) und Inhibitoren (matrix Gla protein, MGP, Fetuin A, Osteoprogerin, Pyrophosphat u. a.) der Kalzinogenese, wesentlich bei. Die daraus resultierende Prokalzinogenese führt zur Präzipitation des initial amorphen und potential noch reversiblen Hydroxyapatits. Durch die nachfolgende Kristallisation des Hydroxyapatits wird das Stadium einer vermutlich weitgehend therapieresistenten medialen Verkalkung erreicht.
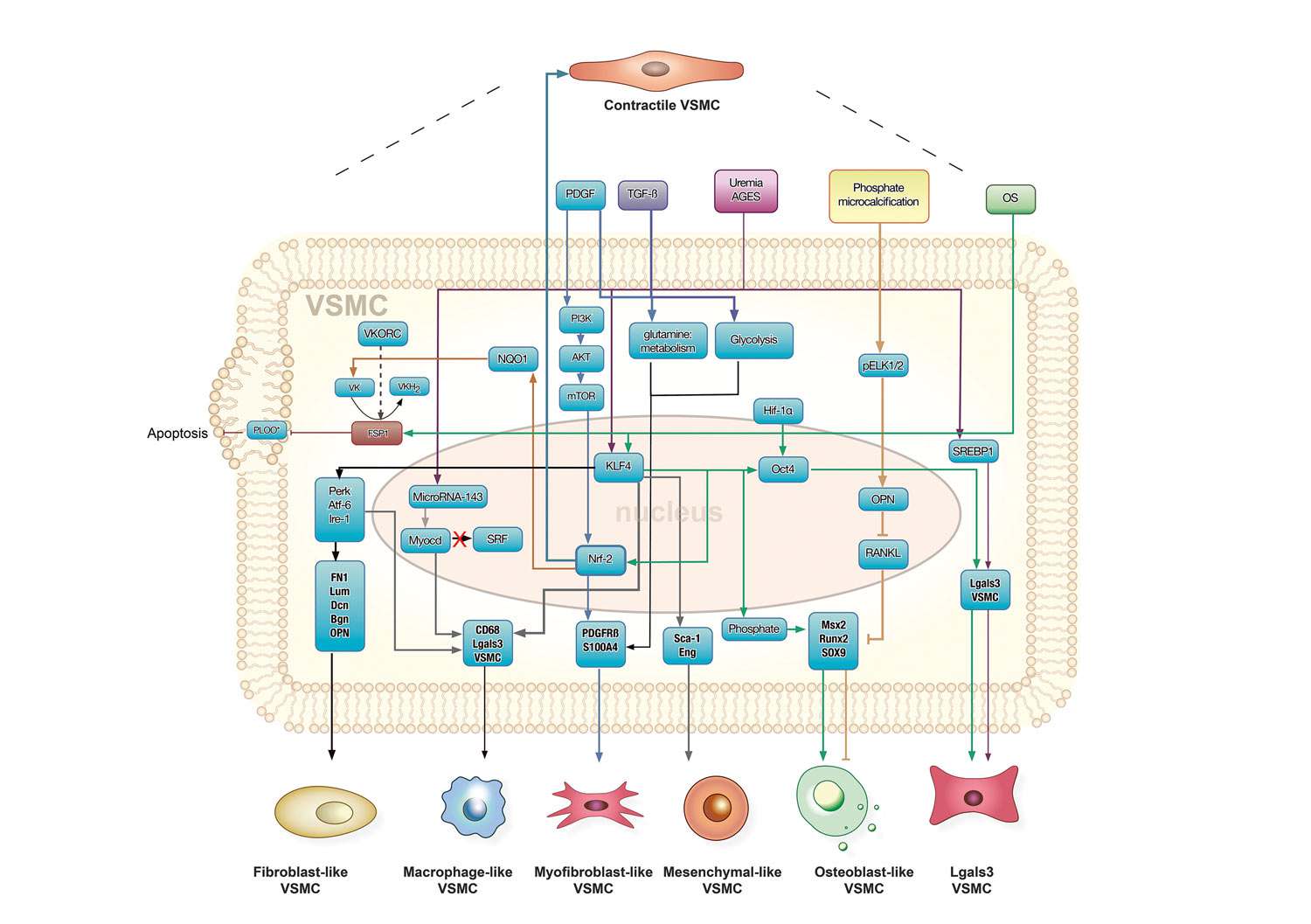
Abbildung 2: Extrazelluläre Stimuli, Signalwege und intrazelluläre Mediatoren des phänotypischen Wandels von glatten Gefäßmuskelzellen. (VSMCs). Farbige Linien zeigen selektive Signalwege von verschiedenen extrazellulären Stimuli (PDGF, TGF-β, Urämie/AGEs, Phosphat/Mikrokalzifikationen und POVPC) über intrazelluläre Mediatoren zur Induktion des phänotypischen Wechsels von VSMCs. Dedifferenzierte VSMCs umfassen: kontraktile VSMCs, fibroblastenähnliche VSMCs, makrophagenähnliche VSMCs, myofibroblastenähnliche VSMCs, mesenchymale VSMCs, osteoblastenähnliche VSMCs (roter Pfeil), sowie Lgals3-positive VSMCs. Abkürzungen und ihre Bedeutungen: AKT – AKT Serin/Threonin-Kinase 1, Atf-6 – Activating Transcription Factor 6, Bgn – Biglycan, CD68 – Cluster of Differentiation 68. Dcn – Decorin, Eng – Endoglin, Hif-1α – Hypoxie-induzierbarer Faktor 1 Subunit Alpha, FN1 – Fibronectin 1, FSP-1 – Ferroptose-Suppressor-Protein 1, KLF4 – Krüppel-ähnlicher Faktor 4, Ire-1 – Serin/Threonin-Protein-Kinase 1, Lgals3 – Galektin 3, Lum – Lumican, Msx2 – Msh-Homeobox-2, Nrf-2 – Nuclear Factor-Erythroid 2-Related Factor 2, PDGF – Platelet-Derived Growth Factor (plättchenabgeleiteter Wachstumsfaktor). mTOR – Mechanistic Target of Rapamycin Kinase, Oct-4 – Octamer-Bindungs-Transkriptionsfaktor 4, OPN – Osteophosphorin, Myocd – Myokardin, PDGFRβ – PDGF-Rezeptor Beta, pELK1/2 – Phospho-ETS-Transkriptionsfaktor 1 und 2, Runx2 – Runt-related Transcription Factor 2, S100A4 – S100-Calcium-bindendes Protein A4, Sca-1 – Stammzell-Antigen 1, Sox9 – SRY-Box Transkriptionsfaktor 9, SRF – Serum Response Factor, SREBP1 – Sterol Regulatory Element-Binding Protein 1, TGF-β – Transforming Growth Factor Beta, POVPC – 1-Palmitoyl-2-(5'-Oxo-Valeroyl)-sn-Glycero-3-Phosphocholin, VK – Vitamin K, VKH2 – Reduziertes Vitamin K, VSMC – Vascular Smooth Muscle Cell (glatte vaskuläre Muskelzelle) (modifiziert aus Ref. 4).
Auswirkungen der Mediasklerose auf die mechanischen Eigenschaften der Arterienwände
Die zunehmende Ablagerung des Hydroxyapatits in der Media führt, neben einigen anderen pathologischen Veränderungen, wie erhöhte Ablagerung des Typ I und III Kollagens, vermehrte Brückenbildung (cross-linking) zwischen Kollagen und den AGEs, Zerstörung der extrazellulären Matrix durch Aktivierung der Metallproteinasen, zu einer zunehmenden Versteifung der Gefäßwand. Bei gleichzeitigem Vorliegen der Arteriosklerose wird ebenfalls die positive Remodellierung der Gefäßwand beeinträchtigt und dadurch die Kompensationsmöglichkeit bei stenotischen Veränderungen eingeschränkt. Die begleitende Intima-Proliferation wird vermutlich durch die Verminderung der auf die Intima einwirkenden Scherkräfte, infolge des reduzierten Blutflusses, verursacht. Abbildung 3 zeigt eine Zunahme der Steifigkeit der Arterienwände als Folge der medialen Verkalkungen.
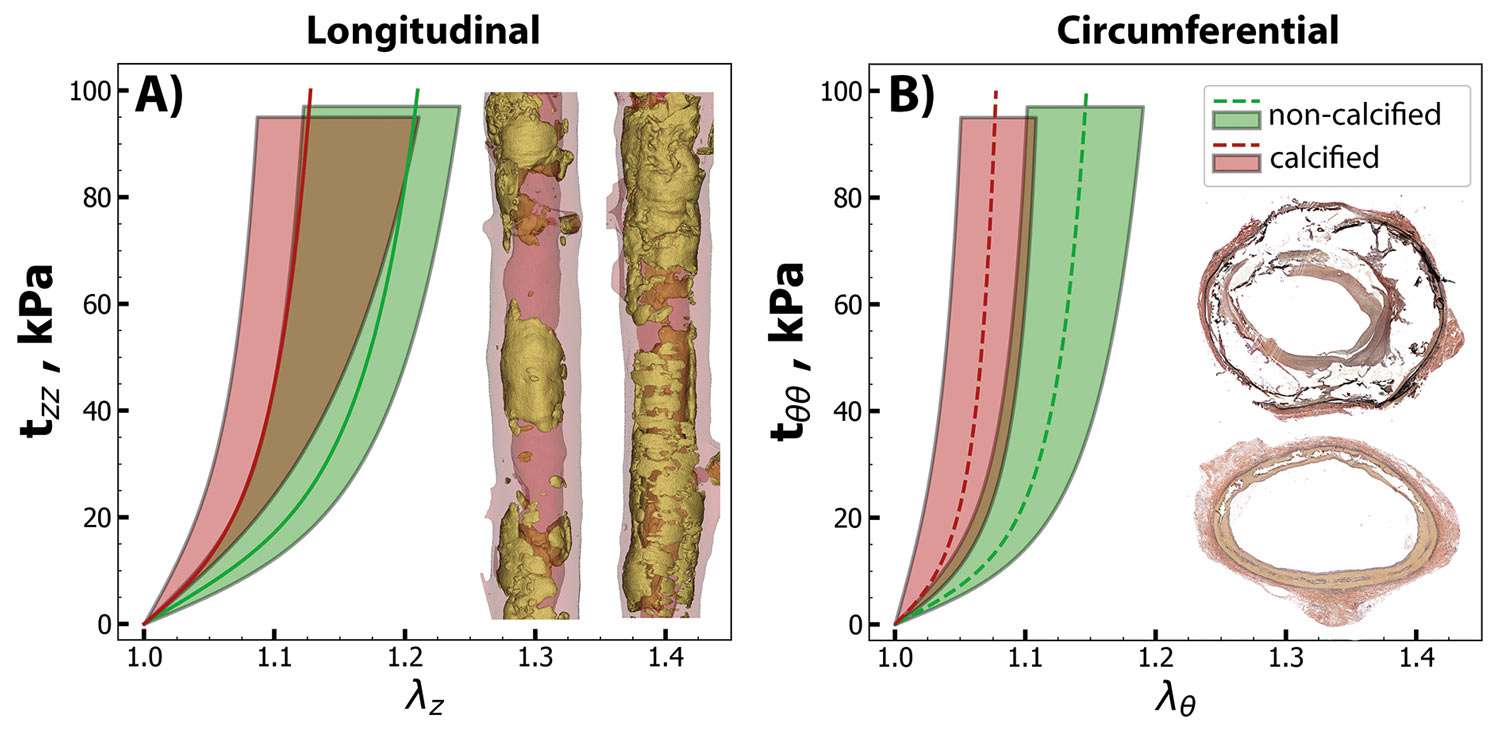
Abbildung 3: Vergleich der Steifigkeit der Arterienwand bei Kalk-freien und bei verkalkten Arterien. Anhand von Messungen der longitudinalen und der zirkumferenziellen Stresse (vertikale Achse) und der longitudinalen und der zirkumferenziellen Streckfähigkeit (horizontale Achse) ist die Verschiebung des Stress-Streck-Verhältnisses in Richtung erhöhter Steifigkeit bei verkalkten Gefäßen, sowohl in der Längs-, als auch in der zirkumferenziellen Richtung, nachweisbar (reproduziert mit freundlicher Genehmigung des European Heart Journal).
Auswirkungen der Mediasklerose auf die Hämodynamik
Die erhöhte Steifigkeit der Arterienwände hat starke Auswirkungen, sowohl auf die zentrale, als auch auf die periphere Hämodynamik. Die erhöhte Steifigkeit der Leitarterien (conduit arteries) führt zu einer Beschleunigung der Pulswellen, sodass die mechanische Wellenreflexion an den arteriellen Verzweigungen früher erfolgt und dadurch, anstatt wie unter physiologischen Bedingungen üblich, die diastolische koronare Perfusion zu unterstützen und den diastolischen Blutfluss zu fördern, treffen die vorzeitig reflektierten Pulswellen in der aszendierenden Aorta in der späten Systole an und erhöhen dadurch die Nachlast der linken Herzkammer. Durch die Erhöhung der Nachlast kann langfristig die Entwicklung einer linksventrikulären Herzinsuffizienz begünstigt werden. Zusätzlich werden durch die erhöhte Steifigkeit der Arterienwände der Pulsdruck und die Pulsatilität des Blutflusses erhöht. Die erhöhte Pulsatilität des Blutflusses kann zu Langzeitschäden, insbesondere der parenchymatösen Organe, wie Gehirn, Leber, Niere, führen.
Anhand mathematischer Modellierung konnte gezeigt werden, dass die im Verlauf zunehmende Steifigkeit der Gefäßwand durch die verminderte systolische Arterienerweiterung zu einem Druckabfall und entsprechender Reduktion des peripheren Blutflusses führt. Die Veränderungen der Hämodynamik der terminalen Strombahn durch die Mediasklerose, und durch die damit assoziierte Intima Proliferation wurden bisher nicht ausreichend untersucht. Da bei einem angiographischen Vollbild der Mediasklerose die peripheren Arterien samt der nachgeschalteten Strombahn kaum, wenn überhaupt, nachweisbar sind, wird eine weitgehende Zerstörung der Endstrombahn angenommen. Gezielte Untersuchungen der mikrozirkulären Hämodynamik bei Patienten mit Mediasklerose liegen jedoch bisher nicht vor.
Klinische Bedeutung
Die durch die Gefäßalterung bedingte Mediasklerose verläuft in der Regel über mehrere Jahrzehnte klinisch stumm. Allerdings kann sie in fortgeschrittenen Stadien, insbesondere bei hochbetagten Personen, auch schwere periphere Durchblutungsstörungen verursachen. Beim Fehlen einer begleitenden Arteriosklerose kann in diesen Fällen das für die periphere arterielle Verschlusskrankheit typische Claudicatio fehlen und die Patienten stellen sich erst mit peripheren Ulzerationen bei ihrem Hausarzt vor. Bei prädisponierten Patienten, vor allem bei Diabetikern und bei chronisch Nierenkranken, können schwere periphere Ischämien mit Ulzerationen und Gangrän deutlich früher auftreten. Die Mediasklerose ist ein wichtiger, unabhängiger Risikofaktor für die chronische, kritische Beinischämie. Aus Gewebsuntersuchungen der amputierten Gliedmaßen ist bekannt, dass die Mediasklerose, mit oder ohne eine begleitende Arteriosklerose, den häufigsten Befund darstellt.
Diagnostik
Die Mediasklerose wird am häufigsten als Zufallsbefund anhand von nativen Röntgenaufnahmen der unteren Extremität diagnostiziert. Bei röntgenologisch sichtbaren medialen Verkalkungen handelt es sich bereits um weit fortgeschrittene Spätstadien; Frühstadien sind weder klinisch noch bildtechnisch feststellbar. Auf den nativen Röntgenbildern wird die Mediasklerose anhand der typischen, regelmäßigen, Strickleiter-ähnlichen Verkalkungsmuster der Arterien erkannt. Bei gleichzeitigem Vorliegen einer Arteriosklerose sind dann zusätzlich versprengte, unregelmäßig verteilte Verkalkungsmuster erkennbar. Im CT sind ähnliche Kalkmuster wie in den nativen Röntgenaufnahmen nachweisbar.
Im Gefäßultraschall sind die, für die Mediasklerose typischen, linearen Streifen mit verstärkter Echogenität entlang der longitudinal abgebildeten Schallkopf-nahen Gefäßwand nachweisbar. Beim Fehlen einer begleitenden Arteriosklerose sind die endothelialen Grenzflächen glatt. Im Farbdoppler zeigt sich in diesen Fällen ein homogenes Blutfluss-Signal. Mittels intravaskulären Ultraschalls und der optischen Kohärenztomographie werden die medialen Verkalkungen als echogene, bzw. als signalarme bogige Streifen erkennbar. In der Abbildung 4 sind einige typische Beispiele der bildgebenden Diagnostik bei Patienten mit einer Mediasklerose zusammengefasst. Beim Vorliegen einer Mediasklerose sollten laborchemische Bestimmungen des Kohlenhydrat- und Fettstoffwechsels, der Nierenwerte sowie der Plasmaspiegel des Parathormons und des Vitamin D
veranlasst werden. Spezielle laborchemische Untersuchungen der einzelnen Promotoren und Inhibitoren der vaskulären Kalzinogenese sind möglich, konnten sich jedoch bisher im klinischen Alltag nicht durchsetzen.
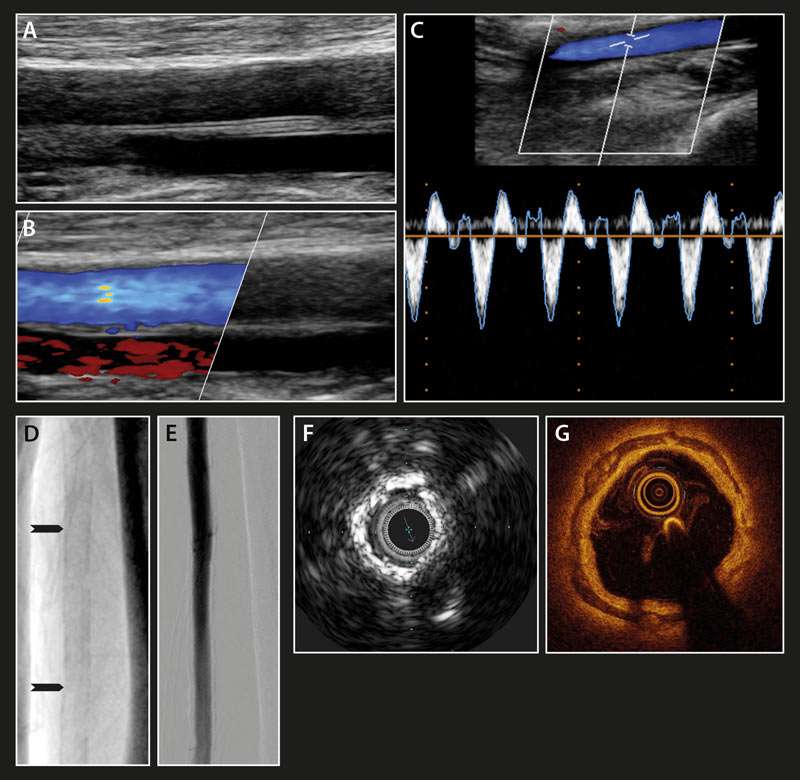
Abbildung 4: Mediaverkalkungen im Spiegel der bildgebenden Verfahren. Dargestellt ist Mediasklerose (roter Pfeil) der Arteria femoris superficialis im Gefäßultraschall: B-Bild (A), Farbduplex (B) und PW-Duplex (C), im Röntgenbild: natives Röntgenbild (D), Digitale Subtraktionsangiographie (DAS) (E). intravaskulärer Ultraschall (F) und optische Kohärenztomographie (G). (modifiziert und reproduziert mit freundlicher Genehmigung des Deutschen Ärzteblattes).
Therapie
Bei vulnerablen Patienten ist eine optimale Kontrolle der bekannten kardiovaskulären Risikofaktoren vordringlich. Eine medikamentöse Therapie der Mediasklerose ist bisher nicht bekannt. Die bisher durchgeführten klinischen Studien mit einer Reihe von Wirkstoffen, wie beispielsweise mit Phosphatadsorbern, Magnesium, Natrium Thiosulfat, Cinacelet, Biphosphonaten haben keine eindeutigen Vorteile zeigen können. Die Ergebnisse der aktuell durchgeführten klinischen Studien mit Carnosin, N-Acetylcystein, Niclosamid, Metformin u. a. liegen noch nicht vor. Anhand der vorläufigen Ergebnisse der laufenden CALCIPHYX, NCT0495906, Phase 3 Studie erscheint der Einsatz des, allerdings lediglich intravenös zu applizierenden, SNF472 (hexasodium myo-inositol hexaphosphat) vielversprechend. Bei fehlenden etablierten Standards für eine medikamentöse Therapie der Mediasklerose, können derzeit keine verbindlichen Therapieempfehlungen ausgesprochen werden. Ohne ausreichende Evidenz wird bei Patienten mit einer Mediasklerose gelegentlich off-label die Einnahme von Vitamin K2 bzw. Magnesium empfohlen. Bei Patienten mit schweren peripheren Durchblutungsstörungen kommen offene operative und endovaskuläre Revaskularisationen in Betracht. Die Abbildungen 5, 6 und 7 zeigen ein typisches Beispiel eines Patienten mit einer fortgeschrittenen Mediasklerose der oberen und der unteren Extremitäten vor und nach der Durchführung einer endovaskulären Revaskularisation.
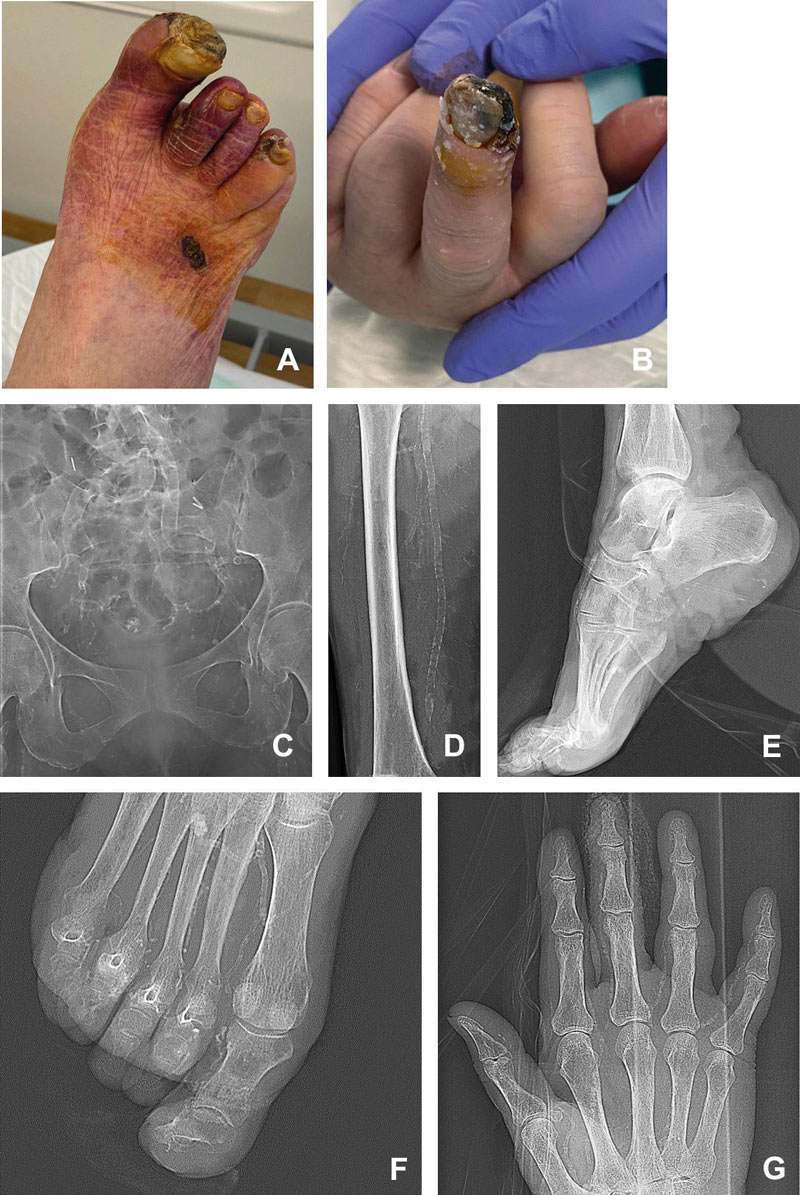
Abbildung 5: Mediaverkalkungen bei einer 66-jährigen Diabetikerin; betroffen sind sowohl die Arterien der oberen als auch der unteren Extremität. Dargestellt sind der rechte Fuß mit ausgedehnten ischämischen Nekrosen im Bereich der Zehen und des Vorfußes (A) und die linke Hand mit Nekrose der Endphalange des D3 (B), die nativen Röntgenbilder des Pelvis (C), des rechten Oberschenkels (D), des Fußes im seitlichen (E) und antero-posteriorem (F) Strahlengang sowie der linken Hand (G). (reproduziert mit freundlicher Genehmigung des European Heart Journal).
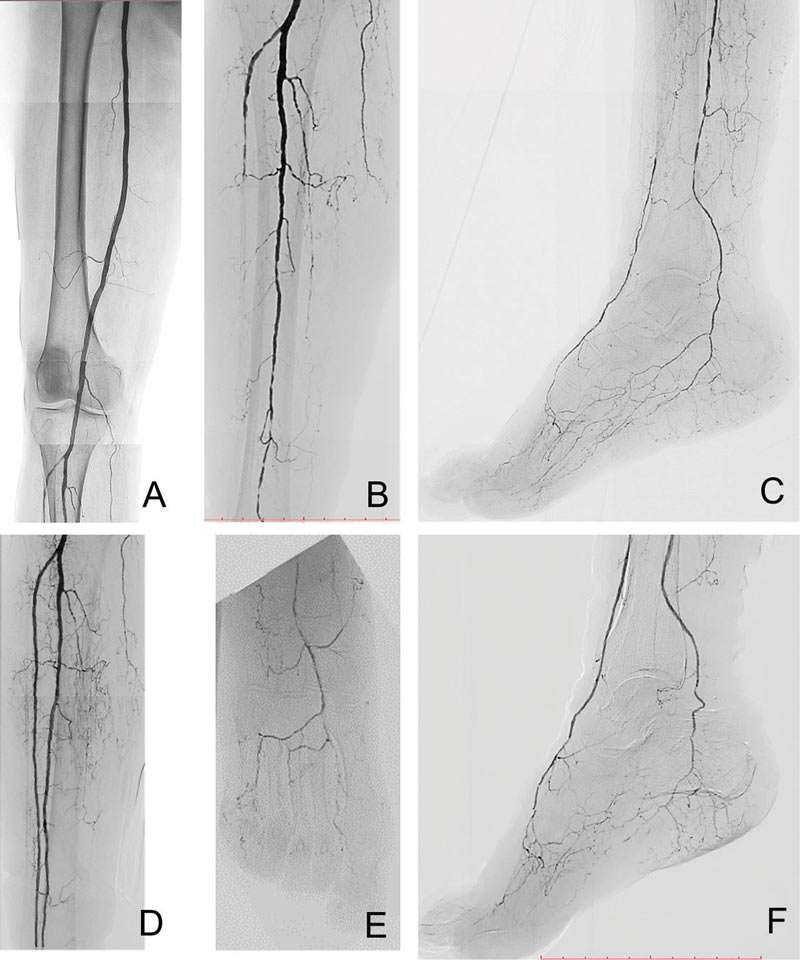
Abbildung 6: Gleiche Patientin wie in Abb. 5; Korrespondierende digitale Subtraktionsbilder des rechten Oberschenkels (A), des rechten Unterschenkels (B) und des rechten Fußes (C) vor peripherer perkutaner transluminaler Angioplastie (PTA). Nach PTA verbesserter Blutfluss in der Arteria peronea/fibularis (D), in den Arterien des Vorfußes und der Zehen (E) und verbesserte Kollateralen der distalen Strecke der Arteria tibialis posterior (F), (reproduziert mit freundlicher Genehmigung des European Heart Journal)
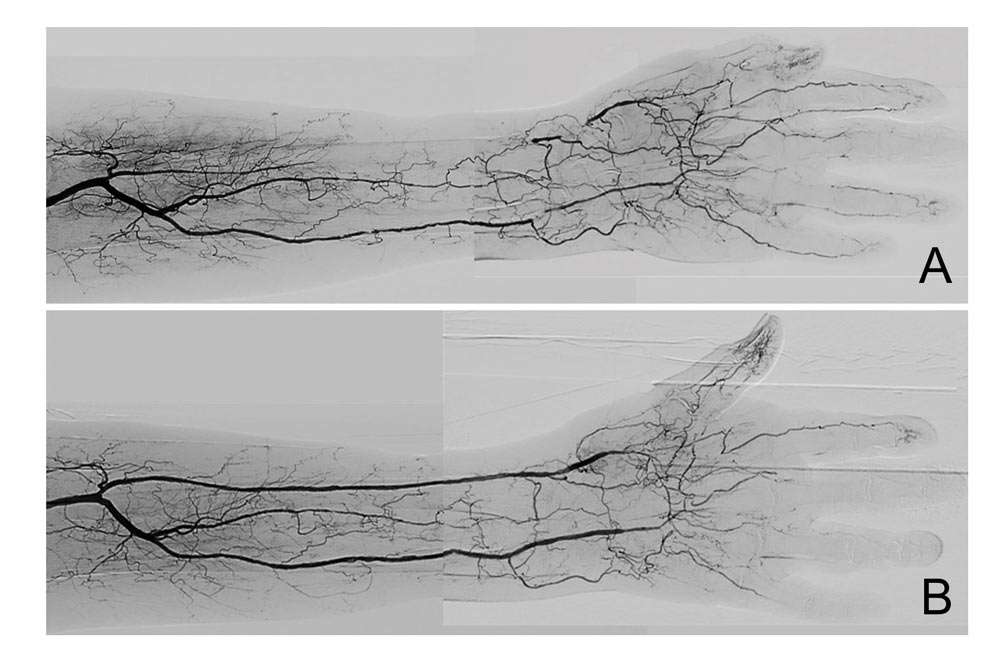
Abbildung 7: Gleiche Patientin wie in Abb. 5; Korrespondierende digitale Subtraktionsbilder des linken Unterarms und der Hand vor (A) und nach der Angioplastie (B), (reproduziert mit freundlicher Genehmigung des European Heart Journal)
Ausblick
Im Hinblick auf die bildgebende Diagnostik sollte der Fokus auf die Entwicklung von hochauflösenden klinisch relevanten Verfahren zur Darstellung von Gefäßverkalkungen gerichtet werden. Dadurch wären die Voraussetzungen für eine wirksame Prävention der Mediasklerose geschaffen. Die Einzel Photon CT Detektion soll eine verbesserte Abbildung von Gefäßverkalkungen ermöglichen.
Im Hinblick auf die molekulare Pathogenese, deren Kenntnis die entscheidende Voraussetzung für eine wirksame Therapie der Mediasklerose darstellt, ist der Einsatz der räumlich aufgelösten Multi-Omics Verfahren vielversprechend.
Korrespondenzanschrift
PD Dr. med. Peter Lanzer
Goitzsche Klinikum
Friedrich-Ludwig-Jahn Straße 2
06749 Bitterfeld-Wolfen
E-Mail:
Literatur
- Mönckeberg JG. Über die reine Mediaverkalkung der Extremitätenarterien und ihr Verhalten zurArteriosklerose. Virchows Path Anat 1903;171:141-167.
- Marchand F. Die Arteriosklerose, S. 23-59, in: Leyden E, Pfeiffer E (Hrsg.), Verhandlungen des Kongresses für Innere Medizin, Wiesbaden: JF Bergmann Verlag, 1904.
- Lanzer P, Sato Y, Virmani R. A rose by any other name would smell as sweet; does nomenclature matter? Eur Heart J, 2022;43:2824-2826.
- Lanzer P, Schurgers L, Twarda-Clapa A, Ferraresi R, Hui H, Kamenskyi A, Chen Y, Hamana T, Fok P-W, Milan A, Virmani R, St. Hilaire C. Medial Arterial Calcification in Aging and Disease; Current Evidence and knowledge gaps. Eur Heart J. 2025 Jun 27:ehaf341. doi: 10.1093/eurheartj/ehaf341. Epub ahead of print. PMID: 40574608. (aktuelle Übersicht mit Einzelnachweisen)
- Lanzer P, Ferraresi R. Medial Sclerosis—Epidemiology and Clinical Significance. Dtsch Arztebl Int 2023; 120: 365-72. DOI: 10.3238/arztebl.m2023.0066.