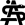Fortschritte in der Pankreaschirurgie
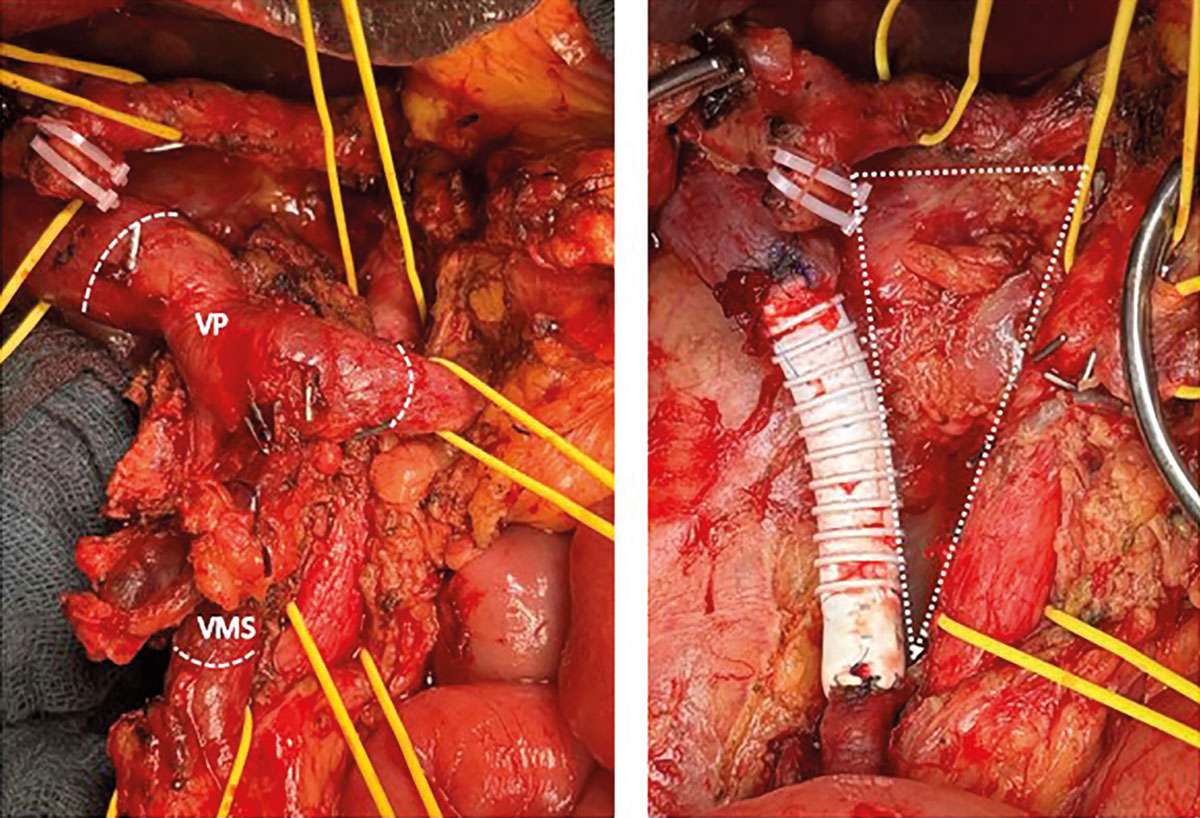
Gefäßresektionen und multimodale Therapiekonzepte beim lokal fortgeschrittenen Pankreaskarzinom
Gefäßresektionen und multimodale Therapiekonzepte beim lokal fortgeschrittenen Pankreaskarzinom
Foto oben: stock.adobe.com/Sebastian Kaulitzki
Artur Rebelo1, Johannes Klose1, Daniel Ebert2, Michael Heuser3, Jonas Rosendahl4, Jörg Kleeff1
1 Universitätsklinik und Poliklinik für Viszeral-, Gefäß- und Endokrine Chirurgie, Universitätsklinikum Halle (Saale), Martin-Luther-Universität Halle-Wittenberg
2 Universitätsklinik für Anästhesiologie und Operative Intensivmedizin, Universitätsklinikum Halle (Saale), Martin-Luther-Universität Halle-Wittenberg
3 Universitätsklinik und Poliklinik für Innere Medizin IV, Universitätsklinikum Halle (Saale), Martin-Luther-Universität Halle-Wittenberg
4 Universitätsklinik und Poliklinik für Innere Medizin I, Universitätsklinikum Halle (Saale), Martin-Luther-Universität Halle-Wittenberg